Chúng ta đã bắt đầu làm quen với môn hóa học từ năm lớp 8. Đây chính là môn học có tính ứng dụng thực tế cao và kích thích sự tìm tòi, đào sâu óc tư duy từ đó phát triển trí não rất tốt cho các em học sinh. Cùng Bamboo School tổng hợp các kiến thức hoá học Trung học cơ sở và Trung học phổ thông qua bài viết sau nhé!
Khái niệm công thức hóa học là gì?
Công thức hóa học được hiểu là một ký hiệu mô tả số lượng và tên nguyên tử có trong một phân tử nào đó. Công thức hóa học cung cấp thông tin về cấu tạo, hình dạng ba chiều của một chất và cách nó sẽ tương tác với các phân tử, nguyên tử và ion khác.
Các ký hiệu trong bảng tuần hoàn hóa học mô tả tên các chất cấu thành một phân tử. Tùy vào nguyên tố mà chỉ số của chúng có thể khác nhau và có tên khác nhau.
Công thức hóa học dùng để biểu diễn thông tin các nguyên tố có trong hợp chất mà bạn muốn tìm hiểu, ngoài ra nó cũng dùng để diễn tả về quá trình xảy ra phản ứng hóa học. Mỗi hợp chất lại có một công thức tìm ra dành riêng, diễn đạt những tính chất đặc thù riêng biệt.

Khái niệm công thức hóa học
Công thức hóa học của đơn chất
Công thức hóa học của một đơn chất là công thức chỉ gồm có kí hiệu hóa học của nguyên tố đó.
- Đối với kim loại: Kí hiệu hóa học của một nguyên tố được coi là CTHH. (Ví dụ, CTHH của Hidro, đồng, sắt, magie, Silic… lần lượt là Ca, u, Fe. Mg, Si…)
- Đối với phi kim:
- Một số phi kim dùng chính của nó kí hiệu hóa học làm CTHH. (Ví dụ: CTHH của cacbon, lưu huỳnh… là C, S.)
- Đa số phi kim còn lại có phân tử thường có 2 nguyên tử liên kết với nhau nên CTHH cũng chính là kí hiệu hóa học và chỉ số dưới chân
(Ví dụ hidro, oxi, nito, clo, bromie … có CTHH lần lượt là H2, O2, N2, Cl2, Br2…)

Công thức hóa học của đơn chất và hợp chất
Công thức hóa học của hợp chất
Công thức hóa học của một hợp chất bao gồm kí hiệu hóa học của những nguyên tố hợp thành và chỉ số ở chân.
CTHH của hợp chất có dạng:
AxBy; AxByCz
Trong đó:
- A, B…: là kí hiệu hóa học của nguyên tố đó.
- x, y,…: là chỉ số nguyên tử của nguyên tố A, B,… (x, y,… là những số nguyên, nếu bằng 1 thì không ghi chỉ số chân)
Ví dụ: CTHH của muối ăn, nước, khí cacbonic, đá vôi, Glucose lần lượt là: NaCl, H2O, CO2, CaCO3, C6H12O6
Ý nghĩa của công thức hóa học
Công thức hóa học của một chất cho biết các yếu tố cơ bản như sau:
- Nguyên tố nào tạo ra chất
- Số nguyên tử của mỗi nguyên tố có trong một phân tử chất đó.
- Phân tử khối của chất.
Ví dụ 1. Công thức hóa học của khí oxi lưu huỳnh cho biết:
- Khí lưu huỳnh do nguyên tố S2 tạo ra.
- Có 2 nguyên tử trong 1 phân tử lưu huỳnh.
- Phân tử khối: 32.2 = 64 (đvC)
Ý nghĩa của công thức hóa học
Tổng hợp các công thức hóa học lớp 8,9 đầy đủ nhất
Công thức tính số mol (Kí hiệu: n; đơn vị: mol)
- n =
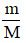
Lưu ý:
- m: khối lượng (KL) (đơn vị: gram).
- M: KL mol (đơn vị: gram/mol).
- n =
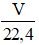
Lưu ý:
- V: thể tích khí ở đktc (đơn vị: lít).
- Công thức này áp dụng cho tính số mol khí ở đktc.
- n = CM.Vdd
Trong đó:
- CM: nồng độ (đơn vị tính: mol/ lít)
- Vdd: thể tích (đơn vị tính: lít)
- n =
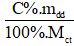
Lưu ý:
- C%: nồng độ phầm trăm (đơn vị: %)
- mdd: KL (đơn vị: gram)
- Mct: KL mol chất tan (đơn vị: gram/mol).
- n =
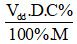
Lưu ý:
- Vdd: thể tích dung dịch (đơn vị: ml)
- D: khối lượng riêng (g/ml)
- C%: nồng độ phầm trăm (đơn vị: %)
- M: KL mol (đơn vị: g/mol).
- n =
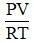
Lưu ý:
- P: áp suất (đơn vị: atm)
- V: thể tích (đơn vị: lít)
- R: hằng số (R = 0,082)
- T: Nhiệt độ kenvin (T = oC + 273)
- n =
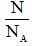
Lưu ý:
- N: số nguyên tử hoặc phân tử.
- NA: số avogađro (NA = 6.1023)
Công thức tính nồng độ phần trăm (C%; đơn vị: %)
8. C% = ![]() .100%
.100%
Lưu ý:
- mct: khối lượng ct (đơn vị: gam)
- mdd: khối lượng dd (đơn vị: gam)
- C% =
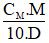
Lưu ý:
- CM: nồng độ mol (đơn vị: mol/ lít)
- M: KL mol (đơn vị: g/mol)
- D: KL riêng (đơn vị: g/ml)
Công thức tính nồng độ mol của một chất (CM; đơn vị: mol/l)
- CM =
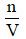
Lưu ý:
- n: số mol chất tan (đơn vị: mol)
- V: thể tích dung dịch (đơn vị: lít)
- CM =
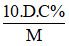
Lưu ý:
- D: khối lượng riêng (đơn vị: g/ml)
- C%: nồng độ phần trăm (đơn vị: C%)
- M: KL mol (đơn vị: g/mol)
Công thức tính khối lượng chất tan (m hoặc mct; đơn vị: gam)
12. m = n.M
Lưu ý:
- n: số mol (đơn vị: mol)
- M: KL mol (đơn vị: g/ mol)
- mct = mdd – mdm
Lưu ý:
- mdd: khối lượng dd (đơn vị: gam)
- mdm: khối lượng dung môi (đơn vị: gam)
- mct =
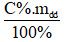
Lưu ý:
- C%: nồng độ phần trăm (đơn vị: %)
- mdd: khối lượng dd (đơn vị: gam).
- mct =
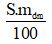
Lưu ý:
- S: độ tan của một chất trong dung môi (đơn vị: gam);
- mdm: KL dung môi (đơn vị: gam);
Công thức tính khối lượng dung dịch (mdd; đơn vị: gam)
16. mdd = mct + mdm
Lưu ý:
- mct: KL chất tan (đơn vị: gam)
- mdm: KL dung môi (đơn vị: gam)
- mdd =
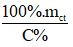
Lưu ý:
- mct: KL chất tan (đơn vị: gam)
- C%: nồng độ phần trăm (đơn vị: C%)
- mdd = Vdd. D
Lưu ý:
- Vdd: thể tích dung dịch (đơn vị: ml)
- D: KL riêng của dung dịch (đơn vị: g/ml)
Công thức tính thể tích dung dịch (Vdd hoặc V)
- Vdd =
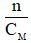
Lưu ý:
- n: số mol (đơn vị: mol)
- CM: nồng độ mol (đơn vị: mol/ lít)
- Vdd: đơn vị lít
- Vdd =
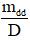
Lưu ý:
- mdd: KL dung dịch (đơn vị: gam)
- D: KL riêng dung dịch (đơn vị: g/ml)
- Vdd: đơn vị ml
Cách tính nguyên tử khối
Để tính được khối lượng thực của nguyên tử (tức là nguyên tử khối), các bạn hãy thực hiện theo 3 bước sau:
- Bước 1: Cần nhớ 1đvC = 1,6605.10^(-27) kg =1,6605.10^(-24) g
- Bước 2:Tra bảng tìm nguyên tử khối của nguyên tố. Ví dụ: nguyên tố A có NTK là a, tức A = a.
- Bước 3: Khối lượng thực của A / mA= a . 0,166.10^(-23) = ? (g)
Ví dụ: Ta có 16g Oxi, hỏi có bao nhiêu nguyên tử Oxi có trong 16g đó?
Bài làm:
16g là Khối lượng tính bằng gram tương ứng với số nguyên tử Oxi
Ta có công thức : Số nguyên tử= Khối lượng tính bằng gam tương ứng với số nguyên tử đó/Khối lượng tính bằng gam của 1 nguyên tử
=> Số nguyên tử trong 16g Oxi là: 16 / (16.1,6605.10^(-24)) = 6,02.10^(-23)
1mol Oxi hay 6.02*1023 nguyên tử Oxi có khối lượng 16g = số đvC của Oxi là 16(đvC)
Vậy Oxi có nguyên tử khối 16đvC => 1 Nguyên tử oxi có khối lượng 16.1,6605.10^(-24) (g)
Định luât bảo toàn khối lượng
Theo Wikipedia, Định luật bảo toàn khối lượng được hai nhà khoa học Mikhail Vasilyevich Lomonosov và Antoine Lavoisier khám phá độc lập với nhau qua những thí nghiệm được đong đếm tỉ mỉ chính xác, từ đó phát hiện ra định luật bảo toàn khối lượng.
Định nghĩa của định luật bảo toàn khối lượng được phát biểu cụ thể như sau: Trong một phản ứng hóa học bất kỳ, tổng khối lượng các chất tạo thành từ phản ứng bằng khối lượng tất cả các chất tham gia phản ứng, chúng chỉ được chuyển đổi từ trạng thái này sang trạng thái khác.
Tính hiệu suất phản ứng
Hiệu suất là phương thức dùng để tính khả năng tránh lãng phí vật liệu, năng lượng, nỗ lực, tiền bạc và thời gian để làm một việc gì đó hay tạo ra kết quả mong muốn.
Công thức tính hiệu suất của phản ứng hóa học và cho ví dụ minh họa:
Ví dụ cho phản ứng hóa học: A + B → C
Hiệu suất phản ứng:
H = số mol phản ứng x 100% / số mol ban đầu hoặc cũng có thể tính theo khối lượng:
H = khối lượng thu được thực tế x 100% / khối lượng thu được tính theo phương trình
Lưu ý là tính hiệu suất theo số mol chất thiếu (theo số mol nhỏ)
Từ công thức cũng có thể tính được:
nC = nA pứ = (nA ban đầu x H) / 100
nA ban đầu cần dùng: nA ban đầu = (nC x 100) / H
CaCO3 → CaO + CO2
0,1 mol → 0,1 mol
Theo phản ứng ta có 0,1 mol CaCO3 tạo 0,1 mol CaO. Tuy nhiên theo thực tế đo được chỉ thu được 0,08 mol CaO. Như vậy đối với CaO lượng tính toán theo phản ứng là 0,1 (gọi là khối lượng theo lý thuyết) và lượng chắc chắn thu được là 0,08 (gọi là lượng thực tế). Hiệu suất phản ứng H(%) = (thực tế/lý thuyết)*100 = (0,08/0,1)*100 = 80%
Công thức tính số mol
Công thức: n = V / 22,4
Trong đó:
- n là số mol chất khí (mol).
- V là thể tích chất khí ở điều kiện tiêu chuẩn (lít).
- 22,4 là hằng số trong điều kiện tiêu chuẩn.
Ví dụ 1: Cho 3,9 gam Kali vào dung dịch HCl dư. Tính thể tích khí hydro thu được ở điều kiện chuẩn.
Lời giải:
Phản ứng xảy ra theo 2 phương trình
2K + 2HCl → 2KCl + H2 ↑ (1)
2K + 2H2O → 2KOH + H2 ↑ (2)
Số mol Kali: nK = 3,9/39 = 0,1 mol
Theo phương trình phản ứng (1) và (2), nH2 = nK = 0,1 mol
Vậy thể tích khí hydro thu được ở điều kiện tiêu chuẩn là: VH2 = 0,1 x 22,4 = 2,24 lít.
Công thức tính tỉ khối của chất khí
Công thức tính tỉ khối của chất khí:
– Tỉ khối của khí A đối với khí B : ![]()
Trong đó:
d(A⁄B) là tỉ khối của khí A đối với khí B
MA là khối lượng mol khí A
MB là khối lượng mol khí B.
Khi: d(A⁄B) > 1 ⇒ khí A nặng hơn khí B
d(A⁄B)= 1 ⇒ khí A nặng bằng khí B
d(A⁄B) < 1 ⇒ khí A nhẹ hơn khí B.
– Tỉ khối của khí A với không khí :
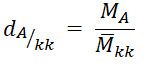
Trong đó:
d(A⁄kk) là tỉ khối của khí A đối với không khí.
MA là khối lượng mol khí A
Mkk là khối lượng mol không khí ( = 29 g/mol)
Khi: d(A⁄kk) > 1 ⇒ khí A nặng hơn không khí.
d(A⁄kk) = 1 ⇒ khí A nặng bằng không khí.
d(A⁄kk) < 1 ⇒ khí A nhẹ hơn không khí.
Ví dụ: Khí CO2 nặng hơn hay nhẹ hơn không khí?
Khối lượng mol phân tử khí CO2 / MCO2 = 44 g/mol
Ta có :
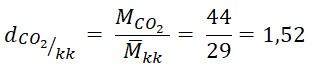
→ Khí CO2 nặng hơn không khí 1,52 lần.
Công thức tính thể tích
Công thức 1: Thể tích chất khí đkc bằng số mol chất khí đắc nhân với 22,4, ta có công thức cụ thể : V = n. 22,4
Trong đó
- V là thể tích chất khí đkc ( lít )
- n là số mol chất khí đkc (mol)
Công thức 2: Tính thể tích chất hoặc dung dịch bằng khối lượng chất hoặc dung dịch nhân với nhối lượng riêng chất hoặc dung dịch , công thức tính cụ thể như sau :V = m / D
Trong đó
- V là thể tích chất hoặc dung dịch
- m là khối lượng chất hoặc dung dịch
- D là khối lượng riêng chất hoặc dung dịch
Công thức 3: Tính thể tích dung dịch bằng số mol chất tan nhân với nồng độ mol của dung dịch , công thức tính cụ thể là V= n / CM
Trong đó:
- V là thể tích dung dịch
- n là số mol chất tan
- CM là nồng độ mol của dung dịch
Công thức 4: Tính thể tích không khí bằng 5 lần thể tích oxi , công thức cụ thể như sau :Vkk = 5.Voz
Trong đó:
- Vkk là thể tích không khí
- Voz là thể tích oxi
Tính thành phần phần trăm về khối lượng của mỗi nguyên tố trong hợp chất
Khi biết công thức của hợp chất đã cho học sinh có thể tính thành phần phần trăm dựa vào khối lượng của các nguyên tố trong hợp chất đó
Công thức:
Tính phần trăm khối lượng = (khối lượng mol nguyên tố / khối lượng phân tử hợp chất) x 100%.
Xác định thành phần phần trăm theo khối lượng của các nguyên tố có trong hợp chất KNO3
Hướng dẫn giải:
- Khối lượng mol của hợp chất: MKNO3 = 39 + 14 + 16.3 = 101 gam/mol
- Trong 1 mol KNO3 có: 1 mol nguyên tử K; 1 mol nguyên tử N và 3 mol nguyên tử O
- Thành phần phần trăm theo khối lượng của các nguyên tố là:
%mK = ![]() = 36,8%
= 36,8%
%mN = ![]() = 13,8%
= 13,8%
%mO = ![]() = 47,6% hoặc %mO = 100% – (36,8% + 13,8%) = 47,6%
= 47,6% hoặc %mO = 100% – (36,8% + 13,8%) = 47,6%
Nồng độ phần trăm
C% = mct / mdd x 100%
Trong đó:
- C%: Nồng độ phần trăm.
- mct: Khối lượng chất tan.
- mdd: Khối lượng dung dịch.
Hòa tan hết 20 gam HCl vào trong 40 gam nước. Hãy tính nồng độ phần trăm của dung dịch này.
Lời giải:
- Ta có khối lượng dung dịch là: mdd = mct + mdm = 20 + 40 = 60 gam

Khái niệm công thức hóa học
- Vậy nồng độ phần trăm dung dịch là: C%= (20/40) x 100% = 33,3 %.
- Kết luận: Vậy nồng độ dung dịch của NaCl là 33,3%.
Nồng độ mol
Ta có công thức: CM = n / Vdd
Trong đó:
- CM là nồng độ mol
- n là số mol chất tan
- Vdd là thể tích dung dịch (đơn vị tính: lít)
Ví dụ: Tính CM của 0,5 mol MgCl2 có trong 1,5 lít dung dịch
Lời giải:
- Áp dụng vào công thức tính CM ta có:
CM = 0,51 x 5 = 0,33 (mol)
Độ tan
Công thức tính độ tan được xác định cụ thể như sau: S = (mct / mdm) x 100
Trong đó:
- mct là khối lượng chất tan
- mdm là khối lượng dung môi
- S là độ tan
Ví dụ: Tính độ tan của MgSO4 ở 20oC biết rắng ở nhiệt độ này 360 ml nước có thể hòa tan tối đa 129,6 gam MgSO4 tạo thành dung dịch bão hòa
Ta có: S = mct / mH2O .100 = 129,6/360 .100 = 36 (g/100g nước)
Tổng hợp các công thức hóa học lớp 10 theo từng chương
Chương 1: Nguyên tử
Số đơn vị điện tích hạt nhân = số proton = số electron. Z = P = E
Số khối A của hạt nhân: là tổng số proton Z và số nơtron N. A = Z + N
Chương 2: Bảng tuần hoàn, định luật tuần hoàn các nguyên tố hóa học
Chương này các em chủ yếu tính toán số proton, nowtron, electron của nguyên tử và tính phần trăm.
Chương 3: Liên kết hóa học
Ta có:
Thể tích của nguyên tử là Vmol
Tính thể tích của 1 nguyên tử:
Thể tích thực là: Vt = V.74
Từ công thức ta tìm được R là bán kính nguyên tử.
Chương 4: Phản ứng oxi hóa – khử
Cân bằng phương trình oxi hóa-khử bằng phương pháp thăng bằng electron. Chương này gồm 2 dạng bài chính:
Dạng 1: Phản ứng oxi hóa – khử không có môi trường
Dạng 2: Phản ứng oxi hóa – khử có môi trường
Chương 5: Nhóm Halogen
Phương pháp trung bình: Với hợp chất muối MX ta có: mMX = mM + mX
Phương pháp bảo toàn nguyên tố: Ví dụ ta có nCl = nHCl = 2nH2
Phương pháp tăng giảm khối lượng: Thường dựa vào khối lượng kim loại phản ứng
Chương 6: Nhóm Oxi
Bài tập xác định thành phần hỗn hợp
Trường hợp xác định % khối lượng các chất A, B, C trong hỗn hợp.
Cách giải:
Gọi x, y, z lần lượt là số mol của các chất A, B, C trong hỗn hợp
–> mhh = xA + yB +zC (1)
Tuỳ theo dữ kiện đề bài ta tìm được å x + y +z (2)
Từ (1) và (2) lập phương trình toán học => đại lượng cần tìm.
Trường hợp xác định % theo thể tích
Cách giải:
Giả sử hỗn hợp gồm 2 khí A, B
X là số mol khí A g số mol khí B là (1-x) ứng với một hỗn hợp khí.
Chương 7: Tốc độ phản ứng và cân bằng hóa học
Biểu thức vận tốc phản ứng:
Xét phản ứng: mA + nB → pC + qD
Biểu thức vận tốc: v= k.(A)m.(B)n
Với k là hằng số tỉ lệ (hằng số vận tốc
(A), (B) là nồng độ mol chất A, B.
5 Mẹo ghi nhớ các công thức hóa học nhanh chóng đơn giản
Cách nhớ 20 nguyên tố đầu tiên trong bảng tuần hoàn các nguyên tố hóa học
Hoàng Hôn Lặng Bờ Bắc
(H, He, Li, Be, B)
Chợt Nhớ Ở Phương Nam
(C, N, O, F, Ne)
Nắng Mai Ánh Sương Phủ
(Na, Mg, Al, Si, P)
Song Cửa Không Ai Cài
(S, Cl, Ar, K, Ca)
Các nhóm trong bảng tuần hoàn hóa học
Nhóm IA: Li – Na – K – Rb – Cs – Fr: Lâu nay không rảnh coi phim.
Nhóm II: Be-Mg-Ca-Sr-Ba-Ra: Bé Mang Cây Súng Bắn Ruồi
Nhóm IIA: Be Mg Ca Sr Ba Ra: Banh Miệng, Cá, Sấu, Bẻ, Răng.
Nhóm IIIA: B Al Ga In Ti: Bán Áo Gấm Ở Tháilan.
Nhóm IVA: C Si Ge Sn Pb: Chó Sực Gà Sáu Phát.
Nhóm VA: N P As Sb Bi: Nhớ Pồ Ắt Sầu Bi.
Nhóm VIA: O S Se Te Po: Ông, Say, Sỉn, Té, Pò.
Nhóm VIIA: F Cl Br I At: Fải, Chi, Bé, Iu, Anh.
Nhóm VIIIA: He Ne Ar Kr Xe Rn: Hằng, Nga, Ăn, Khúc, Xương, Rỗng
Cách cân bằng phản ứng hóa học của Cu với CuHNO3
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO↑ + 4H2O
Bước 1. Viết sơ đồ phản ứng với các chất tham gia xác định nguyên tố có số oxi hóa thay đổi
Bước 2. Viết phương trình:
- Khử (Cho electron)
- Oxi hóa (nhận electron)
Bước 3. Cân bằng electron: Nhân hệ số để: Tổng số electron cho = tổng số electron nhận
Bước 4. Cân bằng nguyên tố: nói chung theo thứ tự
- Kim loại (ion dương)
- Gốc axit (ion âm)
- Môi trường (axit, bazo)
- Nước (cân bằng H2O là để cân bằng hidro)
Bước 5. Kiểm tra số nguyên tử oxi ở hai vế (phải bằng nhau)
Dãy hoạt động hóa học của kim loại
Dãy hoạt động hóa học của kim loại là dãy các kim loại được sắp xếp theo chiều giảm dần mức độ hoạt động hóa học của chúng.
Dãy hoạt động của 1 số kim loại: K, Ba, Ca, Na, Mg, Al, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au.
Tác dụng với O2 :
- Ở nhiệt độ thường: K, Ba, Ca, Na, Mg
- Ở nhiệt độ cao: Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Ag
- Khó phản ứng: Hg, Pt, Au
Tác dụng với nước:
- Tác dụng với nước: K, Ba, Ca, Na, Mg
- Không tác dụng với nước ở nhiệt độ thường: Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Ag, Hg, Pt, Au
Tác dụng với axit thông thường:
- Tác dụng với axit thông thường giải phóng ra hidro: K, Ba, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H)
- Không tác dụng: Cu, Ag, Hg, Pt, Au
Khử oxit:
- H2, CO không khử được oxit: Ba, Ca, Na, Mg, Al, Zn
- Khử được oxit kim loại này ở nhiệt độ cao: Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt
Kim loại đứng trước đẩy kim loại đứng sau ra khỏi muối: Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Ag, Hg, Pt, Au.
Cách nhớ tiếp đầu ngữ trong hoá học hữu cơ
Metan, Etan, Proban, Butan, Pentan, Hexan, Heptan, Octan, Nonan, Decan.
Các tiếp đầu ngữ trong hóa hữu cơ là: Met – Et – Prop – But – Pen – Hex – Hept – Oct – Non – Dec. Cách nhớ:
- Mẹ em phải bón phân hoá học ở ngoài đồng.
- Mê em nên phải bao phen hồi hộp. Ôi người đẹp!
- Mẹ em phải bưng phở hì hụp ở ngoài đường.
- Mắt em phai buồn phút hoàng hôn ở nơi đó.
Tải bảng công thức hoá học lớp 8, 9, 10 chi tiết, đầy đủ nhất
[button size=”small” style=”primary” text=”Tải Ngay” link=”https://drive.google.com/file/d/1OzqIOJrSFOQAQaBp0u6DJp0k9hBBerO9/view?usp=sharing” target=””]
>>> Xem thêm:
- Bảng tuần hoàn các nguyên tố hóa học lớp 8, 9, 10 đầy đủ, mới nhất
- Cách tính điểm trung bình môn THCS, THPT, Đại học chi tiết, mới nhất
- Thể tích là gì? Công thức tính thể tích hóa học và các bài tập có giải
Ở bài viết trên đây, Bamboo đã tổng hợp công thức hóa học lớp 8, 9, 10 đầy đủ nhất. Hy vọng BambooSchool sẽ mang lại những thông tin hữu ích cho các bạn học sinh, các quý thầy cô và các bậc phụ huynh đang có nhu cầu tìm hiểu.











