Một trong những vật liệu phổ biến nhất xung quanh chúng ta chính là kim loại. Vậy kim loại là gì? Tính chất hóa học chung của kim loại như thế nào? Làm sao để học thuộc hết được dãy điện hóa hóa học lớp 9- hoá trung học cơ sở ?
Để nắm vững hết những kiến thức nền tảng của Hóa học vô cơ, các bạn hãy cùng Bamboo tìm hiểu nhé!
Tính chất hóa học chung của kim loại
Kim loại thường biết đến là các nguyên tố hóa học tạo ra được ion dương (cation) và có các liên kết kim loại.
Tính chất vật lý của kim loại
- Tính dẻo, dễ kéo, dễ dát mỏng
- Tính dẫn điện
- Tính dẫn nhiệt
- Ánh kim
Tính chất hóa học chung
- Tác dụng với phi kim
Tác dụng với Oxi: Gần hết các kim loại (ngoài Au, Pt, Ag,…) tác dụng với oxi ở nhiệt độ thường hoặc nhiệt độ cao sẽ tạo thành oxit.
VD: 2Ba + O2 🡪 BaO
- Tác dụng với phi kim khác
Nhiều kim loại tác dụng với phi kim ở nhiệt độ cao sẽ tạo thành muối.
VD: 2Fe + 3Cl2 🡪 FeCl3
- Tác dụng với dung dịch axit
Kim loại tác dụng với dung dịch axit sẽ tạo ra muối và H2
VD: Mg + 2HNO3 🡪 Mg(NO3)2 + H2
Khi tác dụng với dung dịch HNO3 đặc nóng tạo ra muối Nitrat và các loại khí như: NO, NO2, N2 và muối NH4NO3.
VD: Cu + 4HNO3 (đặc nóng) 🡪 Cu(NO3)2 + 2NO2 + 2H2O
Khi tác dụng với dung dịch và H2SO4 tạo ra muối Sunfat và các loại khí như: SO2, H2S và lưu huỳnh.
VD: M + H2SO4 (đặc nóng) 🡪 M2(SO4)n + SO2, S, H2S + H20
Lưu ý: Cr, Al, Fe thụ động với H2SO4 đặc nguội và HNO3 đặc nguội
- Tác dụng với muối
Các kim loại hoạt động mạnh (ngoài Na, K, Ba,…) tác dụng với muối kim loại yếu hơn, tạo ra kim loại và muối mới.
VD: Fe + CuSO4 🡪 FeSO4 + Cu
- Tác dụng với nước
Các kim loại mạnh như Li, Na, K, Ca, Sr, Ba…tác dụng với nước ở nhiệt độ thường tạo thành dung dịch bazơ.
VD: M + nH2O 🡪 M(OH)n + n/2 H2
Kim loại Mg không tan trong nước lạnh, thường tan rất chậm trong nước nóng.
VD: Mg + H2O 🡪 Mg(OH)2 + H2
Một số kim loại trung bình như Mn, Al, Zn, Fe…phản ứng được với hơi nước ở nhiệt độ cao tạo ra oxit kim loại và Hydro.
VD: 3Fe + 4H20 hơi 🡪 FE3O4 + 4H2
>>> Xem thêm: Tính chất hoá học của kim loại
Tính chất hóa học chung của kim loại
Dãy hoạt động hóa học kim loại là gì?
Dãy hoạt động hóa học của kim loại là dãy những kim loại được sắp xếp theo chiều giảm dần độ hoạt động hóa học của chúng.

Dãy hoạt động hóa học kim loại
Tính chất của dãy hoạt động hóa học kim loại
Mức độ hóa học của các kim loại giảm dần từ trái sang phải
- Au là kim loại hoạt động kém nhất còn K là kim loại hoạt động mạnh nhất
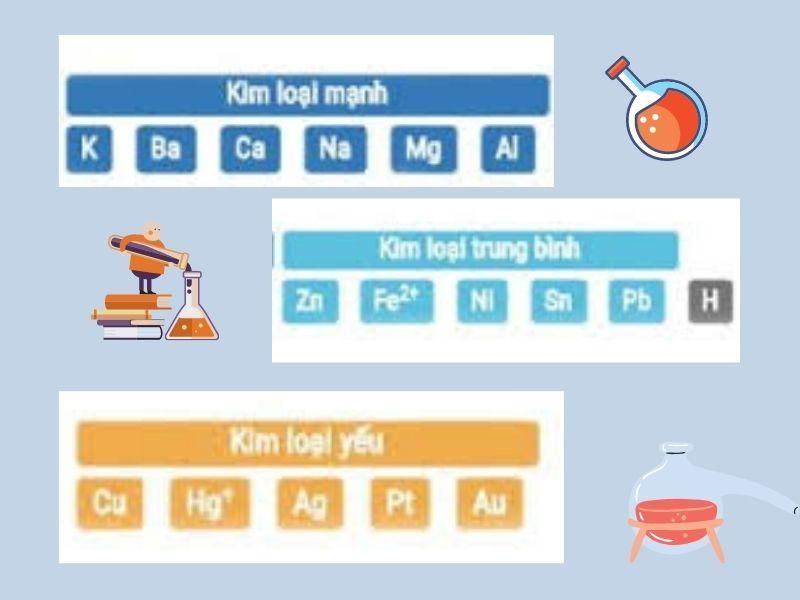
- Các kim loại mạnh nhất: Li, K, Ba, Ca, Na
- Các kim loại mạnh: Mg, Al
- Các kim loại trung bình: Mn, Zn, Cr, Fe, Ni, Sn, Pb
- Các kim loại yếu: Cu, Hg, Ag, Pt, Au
Kim loại đứng trước Mg (K, Ba, Ca, Na) phản ứng được với nước ở nhiệt độ thường.
2Na+2H2O→2NaOH+H2
Ba+2H2O→Ba(OH)2+H2
Kim loại đứng trước H tác dụng với dung dịch axit (HCl; H2SO4 loãng,….) tạo ra H2
Fe + 2HCl → FeCl2 + H2
Cu + 2HCl → không phản ứng (Cu đứng sau H)
Kim loại không tan trong nước (từ Mg trở về sau) đẩy được kim loại đứng sau nó ra khỏi dung dịch muối
Fe + CuSO4 → FeSO4 + Cu
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Lưu ý: Khi cho Na vào dung dịch CuCl2:
- Na phản ứng với nước trước: 2Na + 2H2O → 2NaOH + H2
- Sau đó xảy ra phản ứng: CuCl2 + 2NaOH → Cu(OH)2 + 2Ag
Xếp loại kim loại mạnh, trung bình, yếu
Ý nghĩa của dãy hoạt động hóa học kim loại
Mức độ hoạt động hóa học của các kim loại thường giảm dần từ trái sang phải.
Các kim loại đứng trước Mg là kim loại mạnh (VD: K, Na, Ba,..), tác dụng với nước ở điều kiện thường tạo ra kiềm và H2.
Ví dụ: 2Na + 2H2O → 2NaOH + H2
Các kim loại khi đứng trước H phản ứng với một số dung dịch axit như HCl, H2SO4 loãng, …) tạo ra khí H2.
Ví dụ: Zn + H2SO4 (loãng) → ZnSO4 + H2
Các kim loại khi đứng trước H (trừ Na, K,…) đẩy các kim loại đứng sau tách ra khỏi dung dịch muối.
Ví dụ: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag

Ý nghĩa dãy hoạt động hoá học
Mẹo để học thuộc dãy hoạt động hóa học của kim loại
Một số mẹo để học thuộc dãy hoạt động hóa học của kim loại lớp 9 nhanh chóng:
K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
- Khi cần nàng may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu
- Khi cả nhà may áo giáp sắt nhớ sang phố hàn đồng hiệu Á Phi Âu
Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
- Lúc khó bà cần nàng may áo màu giáp có sắt nhớ sang phố hàn đồng hiệu Á Phi Âu
Xem thêm:
- Tính chất hoá học của muối là gì? Tính chất và các dạng bài tập cơ bản, có đáp án
- Thể tích là gì? Công thức tính thể tích hóa học và các bài tập có giải
- m, M trong hóa học là gì? Tổng hợp công thức liên quan và các dạng bài tập tính m,M,n
Bên trên là một số thông tin cơ bản tổng hợp các tính chất của kim loại và dãy hoạt động hoá học bạn cần biết. Để biết thêm các kiến thức khác liên quan đế hoá học thì hãy vào trang của Bamboo để tìm hiểu nhé. Chúc các bạn có một buổi học thật hiệu quả.









