Chương trình hóa học lớp 12 tương đối dễ nắm bắt nhưng sẽ rất khó nếu như các em bị hụt bài hoặc không theo kịp. Nhằm củng cố kiến thức cho các em theo cách đơn giản nhất, Bamboo đã tổng hợp lại tất cả các công thức hóa học 12 chi tiết nhất trong bài viết dưới đây. Đối với môn học có lượng kiến thức lớn, sẽ dễ hơn rất nhiều nếu các em hiểu và nắm rõ phần lý thuyết cơ bản trước khi “nuốt trọn” các công thức liên quan. Hãy cùng Bamboo tìm hiểu để tải ngay file PDF tổng hợp các công thức cực dễ ôn tập nhé!
Chương 1: Este – Lipit
- Công thức tổng quát của este no, đơn chức, hở:
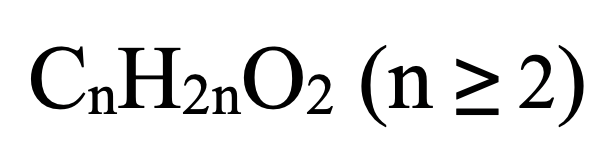
- Tính số đồng phân este đơn chức no:
![]()
- Tính số triglixerit tạo bởi glixerol với các axit cacboxylic béo:
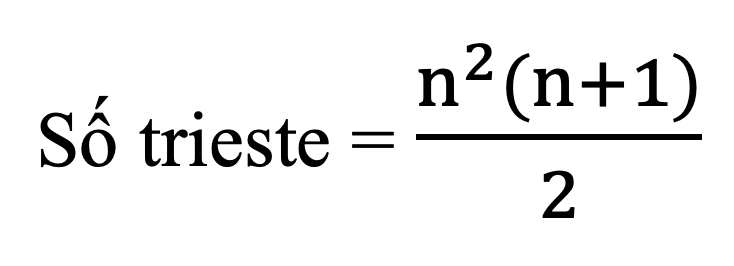
Chương 2: Cacbohiđrat
1. Công thức chung của cacbohiđrat:
![]()
2. Công thức cụ thể của một số cacbohiđrat:
- Tinh bột (hoặc Xenlulozơ):
![]()
- Glucozơ (hoặc Fructozơ):
![]()
- Saccarozơ (hoặc Mantozơ):
![]()
Chương 3: Amin, Amino axit và Protein
- Công thức tổng quát amin no, đơn chức, hở:
![]()
- Tính số đồng phân amin đơn chức no:
![]()
- Tính số đi, tri, tetra…, n peptit tối đa tạo bởi hỗn hợp gồm x amino axit khác nhau:
![]()
- Tính khối luợng amino axit A (chứa n nhóm NH2 và m nhóm COOH ) khi cho amino axit này vào dung dịch chứa a mol HCl, sau đó cho dung dịch sau phản ứng tác dụng vừa đủ với b mol NaOH:
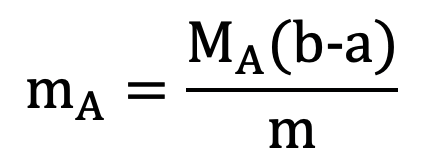
- Tính khối luợng amino axit A (chứa n nhóm NH2 và m nhóm COOH ) khi cho amino axit này vào dung dịch chứa a mol NaOH, sau đó cho dung dịch sau phản ứng tác dụng vứa đủ với b mol HCl:
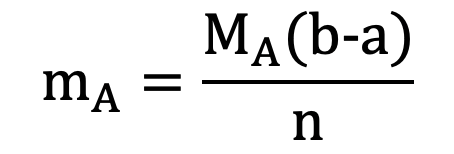
Chương 4: Polime và vật liệu polime
Công thức tính hệ số trùng hợp polime
Giả sử polime có dạng (-A-)n
Ta có:
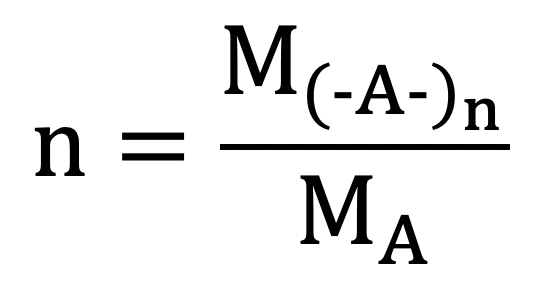
Chương 5: Đại cương về kim loại
1. Dãy hoạt động hóa học của kim loại
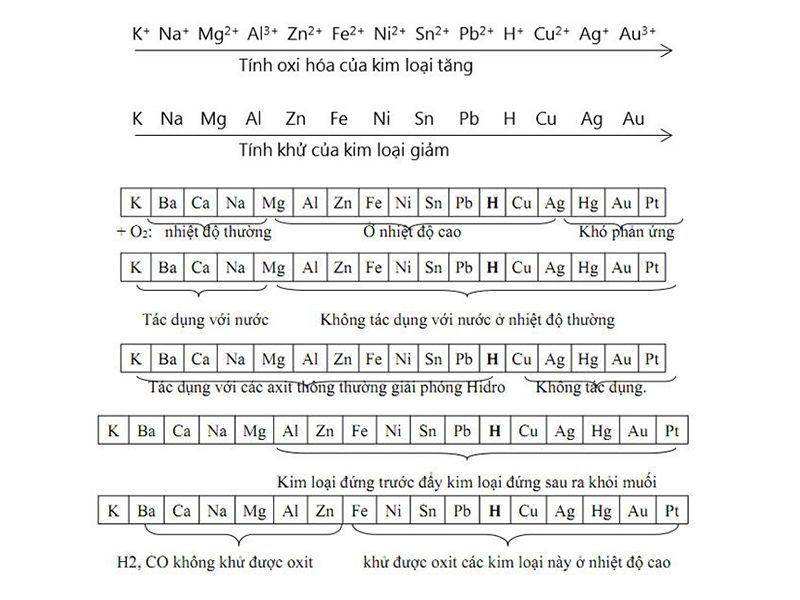
Dãy hoạt động hóa học của kim loại và ý nghĩa
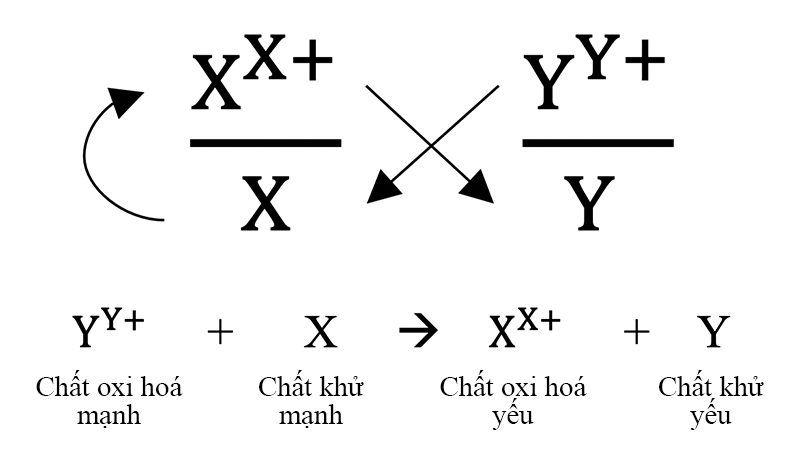
2. Quy tắc anpha
- Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa).
- Áp dụng quy tắc alpha
Phản ứng xảy ra theo chiều mũi tên như sau:
 3. Công thức biểu diễn định luật Faraday
3. Công thức biểu diễn định luật Faraday
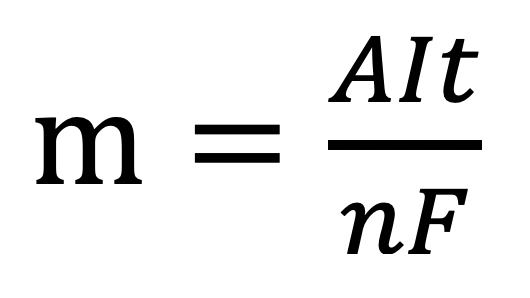
Trong đó:
- m: Khối lượng chất thu được ở điện cực, tính bằng gam.
- A: Khối lượng mol nguyên tử của chất thu được ở điện cực.
- n: Số electron mà nguyên tử hoặc ion đã cho hoặc nhận.
- I: Cường độ dòng điện, tính bằng ampe (A).
- t: Thời gian điện phân, tính bằng giây (s).
- F: Hằng số Faraday (F = 96 500 Culong/mol)
Chương 6: Kim loại kiềm, kim loại kiềm thổ, nhôm
1. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd Ca(OH)2 hoặc Ba(OH)2:
![]()
2. Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd chứa hỗn hợp NaOH và Ca(OH)2 hoặc Ba(OH)2:
- Trước hết tính:

- Sau đó so sánh với nBa2+ hoặc nCa2+ để xem chất nào phản ứng hết
3. Tính thể tích CO2 cần hấp thụ hết vào dd Ca(OH)2 hoặc Ba(OH)2 thu được lượng kết tủa theo yêu cầu:
Trường hợp 1: nCO2 = n↓
Trường hợp 2: nCO2 = nOH- – n↓
4. Tính Vdd NaOH cần cho vào dd Al3+ để xuất hiện lượng kết tủa theo yêu cầu:
Trường hợp 1: nOH- = 3n↓
Trường hợp 2: nOH- = 4nAl3+ – n↓
Kết quả trên tương ứng với hai trường hợp NaOH dùng thiếu và NaOH dùng dư.
- Trường hợp 1 ứng với kết tủa chưa đạt cực đại;
- Trường hợp 2 ứng với kết tủa đã đạt cực đại sau đó tan bớt một phần.
5. Tính Vdd HCl cần cho vào dd Na[Al(OH)]4 (hoặc NaAlO2) để xuất hiện lượng kết tủa theo yêu cầu:
Trường hợp 1: nH+ = n↓
Trường hợp 2: nH+ = 4nNa[Al(OH)]4- – 3n↓
Chương 7: Sắt và một số kim loại quan trọng
1. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp kim loại bằng H2SO4 loãng giải phóng H2:
![]()
2. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl giải phóng H2:
![]()
3. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp oxit kim loại bằng H2SO4 loãng:
![]()
4. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp oxit kim loại bằng dd HCl:
![]()
5. Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl vừa đủ:
![]()
6. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2:
![]()
7. Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng giải phóng khí SO2, S, H2S:

8. Tính số mol HNO3 cần dùng để hòa tan hỗn hợp các kim loại:

Lưu ý:
- Không tạo ra khí nào thì số mol khí đó bằng 0.
- Giá trị nHNO3 không phụ thuộc vào số kim loại trong hỗn hợp.
- Công thức này chỉ dùng khi cho hỗn hợp kim loại tác dụng với HNO3.
- Chú ý khi tác dụng với Fe3+ vì Fe khử Fe3+ về Fe2+ nên số mol HNO3 đã dùng để hoà tan hỗn hợp kim loại nhỏ hơn so với tính theo công thức trên. Vì thế phải nói rõ HNO3 dư bao nhiêu %.
9. Tính số mol H2SO4 đặc, nóng cần dùng để hoà tan 1 hỗn hợp kim loại dựa theo sản phẩm khử SO2 duy nhất:
![]()
10. Tính khối lượng muối nitrat kim loại thu được khi cho hỗn hợp các kim loại tác dụng HNO3 (không có sự tạo thành NH4NO3):

Lưu ý:
- Không tạo ra khí nào thì số mol khí đó bằng 0.
- Nếu có sự tạo thành NH4NO3 thì cộng thêm vào mNH4NO3 có trong dd sau phản ứng.
11. Tính khối lượng muối thu được khi cho hỗn hợp sắt và các oxit sắt tác dụng với HNO3 dư giải phóng khí NO:
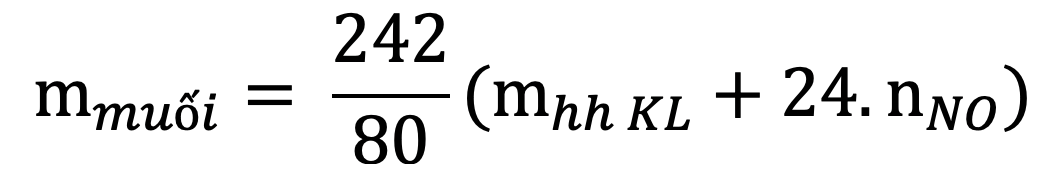
12. Tính khối lượng muối thu được khi hoà tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 bằng HNO3 đặc, nóng, dư giải phóng khí NO2:
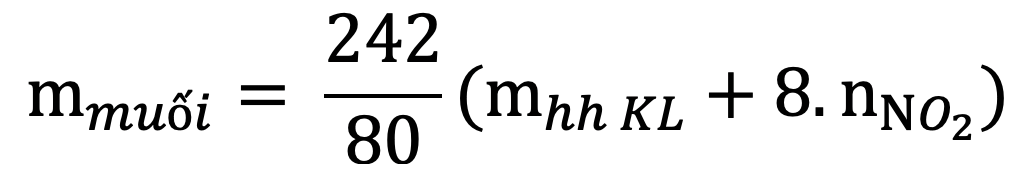
Lưu ý:
- Hỗn hợp không nhất thiết phải đủ bốn chất vẫn có thể áp dụng được công thức.
- Dạng toán này, HNO3 phải dư để muối thu được là Fe (III). Không được nói HNO3 vừa đủ vì có thể phát sinh Fe dư khử Fe3+ về Fe2+ :
- Nếu giải phóng hỗn hợp NO và NO2 thì công thức là:

13. Tính khối lượng muối thu được khi hoà tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 bằng H2SO4 đặc, nóng, dư giải phóng khí SO2:
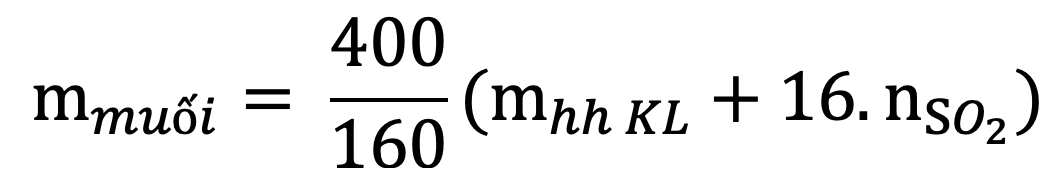
Lưu ý: Hỗn hợp không nhất thiết phải đủ 4 chất vẫn có thể áp dụng được công thức.
14. Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được hỗn hợp rắn X. Hoà tan hết rắn X trong HNO3 loãng dư được NO:
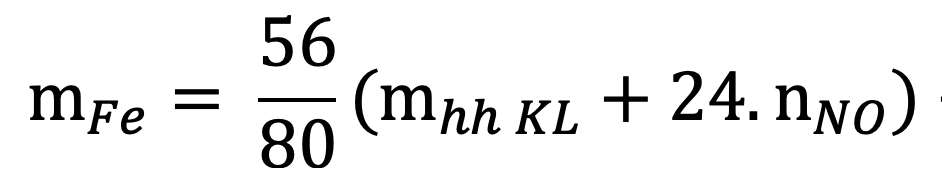
15. Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được hỗn hợp rắn X. Hoà tan hết rắn X trong HNO3 loãng dư được NO2:
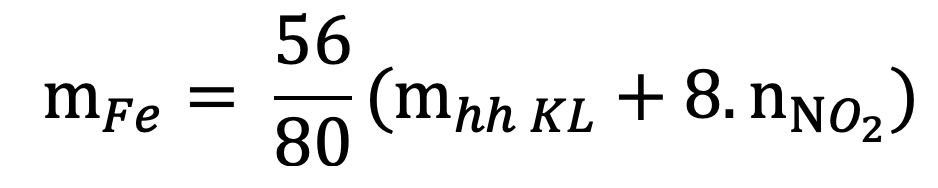
16. Tính thể tich khí NO (hoặc NO2) thu được khi cho hỗn hợp sản phẩm sau phản ứng nhiệt nhôm (hoàn toàn hoặc không hoàn toàn) tác dụng với HNO3:

17. Tính m gam Fe3O4 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng HNO3 loãng dư được khí NO là duy nhất:
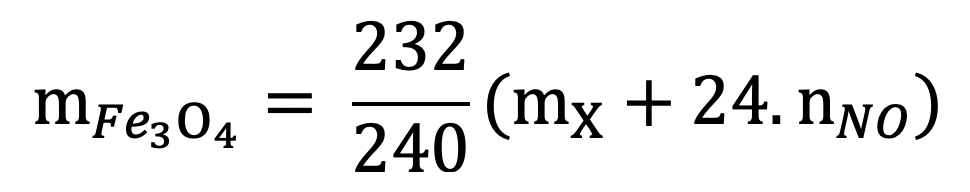
18. Tính m gam Fe3O4 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
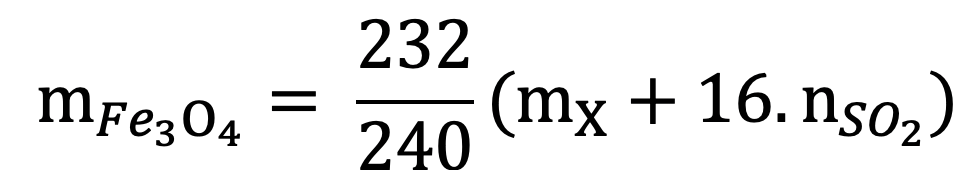
Lưu ý:
Khối lượng Fe2O3 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất:
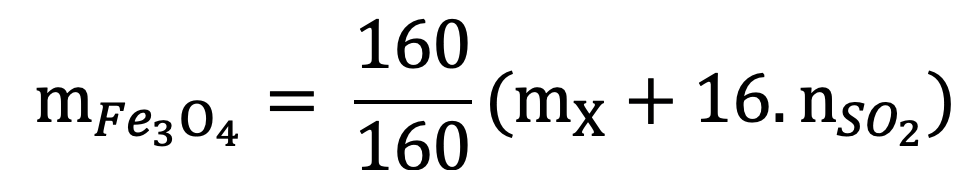
Một số công thức tính nhanh đồng phân dễ nhớ
Số đồng phân ancol đơn chức no CnH2n+2O:
Công thức: Số ancol CnH2n+20 = 2n-2 (n = 6)
Ví dụ : Tính số đồng phân ancol no, đơn chức, mạch hở từ
C3 – C5 C3H7OH: 23-2 = 2 đồng phân.
Số đồng phân amin đơn chức no CnH2n+3N
Công thức: Số amin CnH2n+3N = 2n-1 (n = 5)
Cách tính số đồng phân Ankin CnH2n-2 (n ≥ 2)
Mẹo tính nhanh đồng phân ankin:
Xét 2C mang nối ba, mỗi C sẽ ghép với 1 nhóm thế (giống | hoặc khác nhau).
Ví dụ với C4H6: Trừ đi 2C mang nối ba sẽ còn 2C và H là nhóm thế. C1 C2 1C 1C 1H đồng phân 2C H1 đồng phân. Ta có 2 đồng phân ankin.
Số đồng phân axit cacboxylict đơn chức no CnH2nO2
Công thức: Số axit CnH2nO2 = 2n-3 (n < 7)
Số đồng phân andehit đơn chức no CnH2nO
Công thức: Số andehit CnH2nO = 2n-3 (n < 7)
Áp dụng: Tính số đồng phân anđehit sau: C3H6O, C4H8O
C3H60, C4H8O là công thức của anđehit no, đơn chức, mạch hở.
Với C3H60: 23-3 = 1 đồng phân: CH3CH2CHO
Với C4H80: 24-3 = 2 đồng phân: CH3CH2CH2CHO; (CH3)2CHCHO
Số đồng phân este đơn chức no CnH2nO2
Công thức: Số este CnH2n02 = 2n-2 (n < 5)
Dãy điện hóa cần nhớ
K Na Ba Ca Mg Al Zn
Khi Nào Bà Con May Áo Dài
Fe Ni Sn Pb H
Phái Người Sang Phố Hỏi
Cu Hg Ag Pt Au
Cửa Hiệu Á Phi Âu.
Hoặc chúng ta cũng có thể sử dụng mẹo học thuộc dãy điện hóa khác
Lúc khác Ba Cần Nên Mang Áo Giáp Có Sắt2/Sắt Nên sang Phố Sắt3/Sắt Hỏi cửa Hàng Sắt3/Sắt2 Hiệu Á Phi Âu
Li−K−Ba−Ca−Na−Mg−Al−Zn−Cr−Fe2+/Fe−Ni−Sn−Pb−Fe3+/Fe−H−Cu−Hg− Fe3+/ Fe2+−Hg−Ag−Pt−Au
Tải file tổng hợp công thức hoá học 12 đầy đủ nhất
[button size=”medium” style=”secondary” text=”TẢI NGAY CÔNG THỨC HOÁ 12″ link=”https://drive.google.com/file/d/1cDweOUwR7yLSYAa7_6pwIKsSL7CDUwO_/view?usp=sharing” target=””]
Xem thêm:
- Công thức hóa học là gì? Tổng hợp công thức hóa học lớp 8, 9, 10 đầy đủ nhất
- Thể tích là gì? Công thức tính thể tích hóa học và các bài tập có giải
- Nồng độ dung dịch là gì? Công thức tính nồng độ dung dịch và các bài tập cơ bản có giải
Với bài viết tổng hợp công thức hóa học 12 của Bamboo trên đây. Hy vọng các bạn có thể dễ dàng nắm vững kiến thức của chương trình học lớp 12 và chuẩn bị tốt nhất cho kì thi tốt nghiệp nhé! Các bạn có thể các em cùng tham khảo thêm một số tài liệu hữu ích liên quan đến những môn học khác trong quá trình học tập.











