Electron là một nền tảng kiến thức cơ bản trong lĩnh vực hóa học. Để chắc chắn rằng bạn sẽ không bị “mất gốc” và luôn có thể hiểu bài thì đừng quên nắm chắc cho mình kiến thức về electron nhé! Tại bài viết này, Bamboo School sẽ giúp các nắm rõ các kiến thức và lý thuyết về electron, cùng với đó sẽ là một số mẹo giúp các bạn học sinh dễ dàng ghi nhớ và viết được cấu hình electron. Hãy theo dõi thật kỹ bài viết sau đây để không bỏ lỡ mảng kiến thức nào nhé!
Electron là gì? Khái niệm lý thuyết về electron
Electron chính là các hạt bao quanh hạt nhân và chúng mang điện tích âm. Vật chất được cấu thành từ những nguyên tử, bên trong những hạt nguyên tử này sẽ là một hạt nhân với điện tích dương và các hạt electron bao bọc bên ngoài nó.
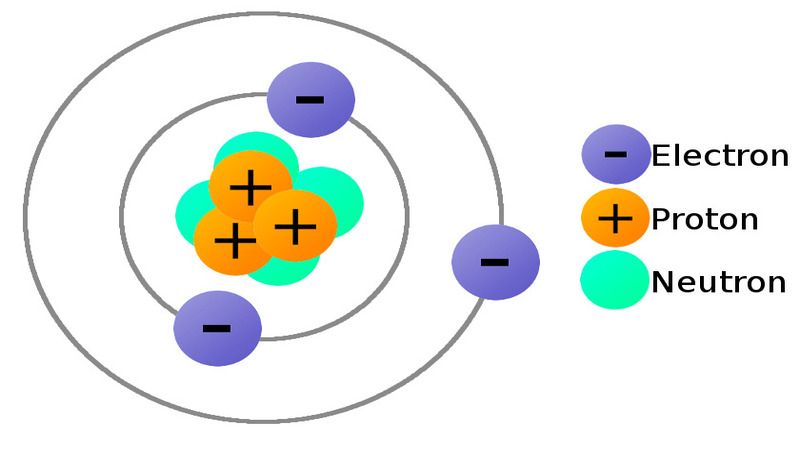
Cấu tạo một nguyên tử
Thuyết electron
Thuyết này chính là dựa vào sự cư trú và di chuyển của các hạt electron nhằm giải thích các hiện tượng điện và các tính chất điện của các vật. Nội dung của thuyết electron như sau:
- Electron có thể rời khỏi nguyên từ để di chuyển từ nơi này sang nơi khác trong phạm vi thể tích của vật dẫn. Trong trường hợp này, nguyên tử bị mất đi electron sẽ trở thành hạt mang điện dương (còn gọi là ion dương)
- Một nguyên tử trung hòa (không mang điện) có thể nhận thêm electron và nó sẽ trở thành hạt mang điện âm (còn gọi là ion âm)
- Một vật thể nhiễm điện âm khi nó có số electron nhiều hơn số proton. Và nếu ngược lại thì nó sẽ mang điện dương.
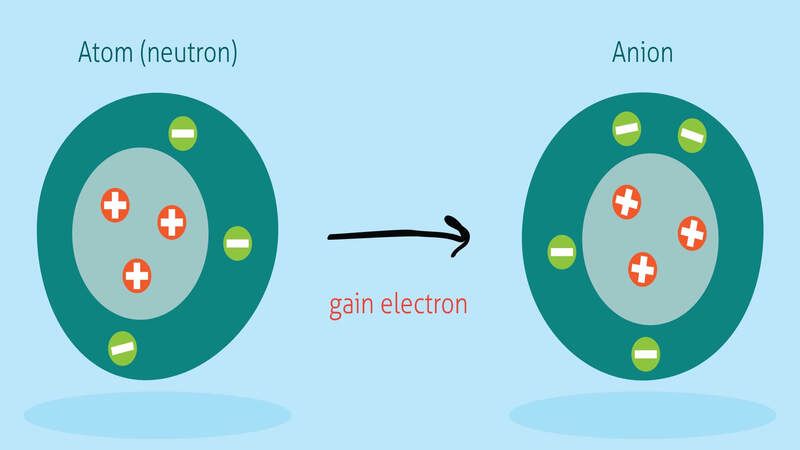
Các electron di chuyển giữa các nguyên tử
Cấu hình electron nguyên tử
Trong một nguyên tử, các electron đều sẽ được phân chia ra theo từng lớp và chúng sẽ mang năng lượng riêng. Và cụ thể, electron trong một phân tử cơ bản sẽ được phân bổ như sau:
- Chúng luôn được sắp xếp theo mức năng lượng tăng dần.
- Có 7 bậc năng lượng (tăng dần từ 1 đến 7) và xếp theo thứ tự các lớp s, p, d, f.
- Với mức điện hạt nhân lớn hơn thì mức năng lượng 4s sẽ thấp hơn 3d.
- Số electron tối đa có thể xếp ở mỗi phân lớp sẽ là s2, p6, d10, f14.
- Số electron tối đa được xếp ở mỗi lớp thứ n là 2n2 với n = 1, 2, 3, 4.
Bảng mức năng lượng cấu hình electron
| Số thứ tự lớp (n) | 1 | 2 | 3 | 4 |
| Tên của lớp | K | L | M | N |
| Số electron tối đa | 2 | 8 | 18 | 32 |
| Số phân lớp | 1 | 2 | 3 | 4 |
| Kí hiệu phân lớp | 1s | 2s 2p | 3s 3p 3d | 4s 4p 4d 4f |
| Số electron tối đa ở phân lớp và ở lớp | 2 | (2,6) → 8 | (2, 6, 10) → 18 | (2, 6, 10, 14) → 32 |
Ngoài các lớp K, L, M, N thì còn có các lớp O, P, Q,… cho tới khi các electron được sắp xếp đủ vào các lớp.
Đặc điểm lớp electron ngoài cùng
Các electron lớp ngoài cùng chính là yếu tố quyết định nên tính chất hóa học của một nguyên tố.
- Số electron lớp ngoài cùng của nguyên tử mỗi nguyên tố là tối đa 8 electron (8e). Các nguyên tử nào có cho mình 8e lớp ngoài cùng đều rất bền vững và hầu như không tham gia vào các phản ứng hóa học. Thông thường đó sẽ là các nguyên tử khí hiếm (ngoại trừ He với 2e lớp ngoài cùng).
- Nguyên tử kim loại: có 1, 2, 3e lớp ngoài cùng (trừ H, He và B)
- Nguyên tố phi kim: thường có 5, 6, 7e lớp ngoài cùng.
- Nguyên tử kim loại hoặc phi kim: có 4e lớp ngoài cùng.
Cách viết cấu hình Electron
Để viết được một cấu hình electron hoàn chỉnh của một nguyên tố hóa học, chúng ta có 3 bước cụ thể sau đây:
- Bước 1: Xác định số e (electron) của nguyên tử (Z).
Ví dụ: nguyên tử Na có số tổng số electron là 11 (Z = 11).
- Bước 2: Sắp xếp các e theo thứ tự tăng dần mức năng lượng.
1s22s22p63s23p64s23d104p6…
Ví dụ: đối với nguyên tố Na có Z = 11 → 1s22s22p63s2
- Bước 3: Sắp xếp cấu hình e: theo thứ tự từng lớp (1→7), trong mỗi lớp theo thứ tự từng phân lớp (s→p→d→f).
Ví dụ: Na (Z = 11) → 1s22s22p63s1
Nguyên lý viết cấu hình electron nguyên tử
Để viết được chính xác cấu hình electron của một nguyên tử, điều trước tiên ta cần phải xác định được đúng số hạt electron mà nguyên tử này có (kiểm tra qua bảng tuần hoàn hóa học). Và điều quan trọng tiếp theo là các bạn cần phải nắm rõ và thuộc được mức năng lượng cấu hình electron và số electron ở mỗi lớp.
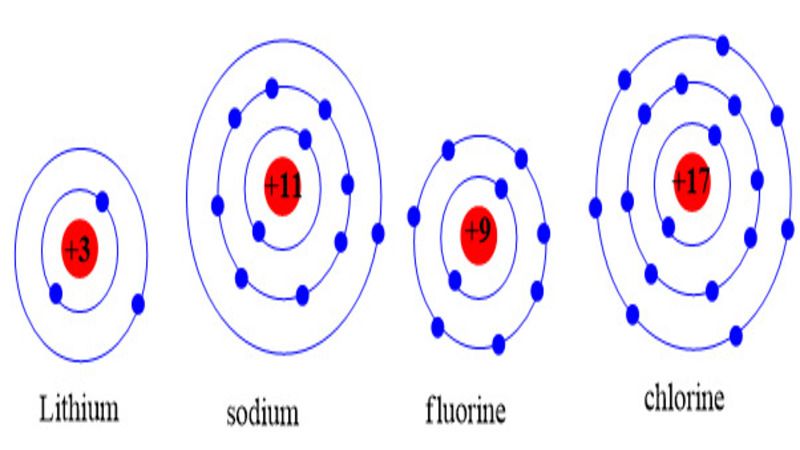
Số electron của mỗi nguyên tử là khác nhau
Tuy nhiên cũng đừng quá lo lắng nhé! BamBoo School đã chuẩn bị một số mẹo học cấu hình electron ở bên dưới cho các bạn học sinh đấy!
Các bước viết cấu hình electron
Cấu hình electron sẽ được viết trong 3 bước đơn giản như đã hướng dẫn cụ thể bên trên.
- Bước 1: Xác định số e của nguyên tử cần viết cấu hình.
- Bước 2: Sắp xếp các e này theo thứ tự tăng dần mức năng lượng.
- Bước 3: Sắp xếp cấu hình e cho phù hợp.
Mẹo viết cấu hình electron
Một mẹo đơn giản để viết được cấu hình electron đó là ghi nhớ
(thứ tự tăng mức năng lượng của các phân lớp). Tuy nhiên để đơn giản hóa quá trình này, BamBoo School đã chuẩn bị một sơ đồ thu gọn dành cho các bạn học sinh.

Quy tắc Klechkowski
Bạn chỉ cần ghi nhớ bảng cấu hình electron cụ thể sau đây và thứ tự di chuyển của mũi tên là sẽ không bị nhầm lẫn giữa các bậc năng lượng!
Cách viết cấu hình electron rút gọn
Một nguyên tử có nhiều electron sẽ có cấu hình electron tương đối phức tạp và dài. Vậy nên cách viết cấu hình electron rút gọn ra đời với mục đích thu gọn cấu hình và ta có thể dễ dàng đọc được cấu hình được viết hơn.
Để dễ hình dung, thao tác này được hiểu là thay thế các lớp năng lượng đầu tiên của nguyên tử bằng tên của một nguyên tử khác có cấu hình tương đương.
Ví dụ:
Cl (Z = 17): 1s22s22p63s23p5
⇒ Cl: [Ne]3s23p5
Trước tiên, bạn cần nắm chắc cấu hình của một số nguyên tố cơ bản như sau:
- Hidro (Z = 1): 1s1
- Heli (Z = 2): 1s2 đã bão hòa.
- Liti (Z = 3): 1s22s1
- Neon (Z = 10): 1s22s22p6
- Và một số nguyên tố cơ bản khác
Bước 1: Xác định số e của nguyên tử cần viết cấu hình.
Bước 2: Sắp xếp các e này theo thứ tự tăng dần mức năng lượng.
Bước 3: Sắp xếp cấu hình e cho phù hợp.
Bước 4: Thay thế cấu hình electron phía trước bằng các nguyên tố có cấu hình tương đương.
Cách xác định electron nguyên tử
Số electron của mỗi nguyên tử là cố định và luôn được đề cập trong các bản nguyên tố hóa học. Vậy nên để xác định được số electron của một nguyên tử thì bạn hãy dò bản nguyên tố hóa học nhé!

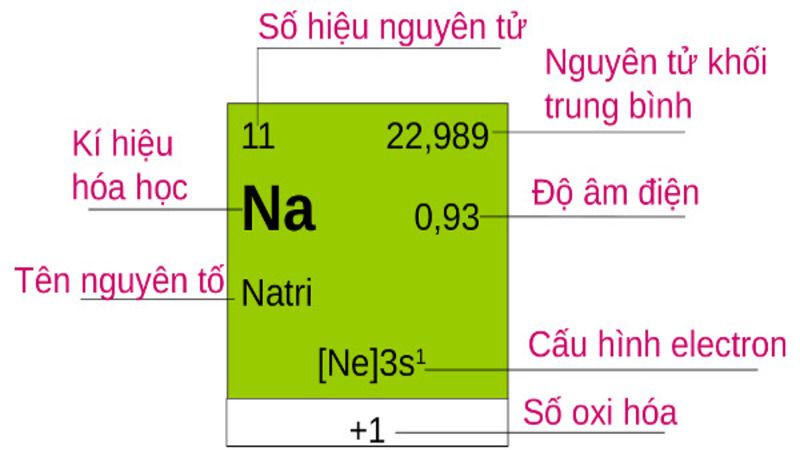
Ý nghĩa các con số của một nguyên tố hóa học trong bảng tuần hoàn
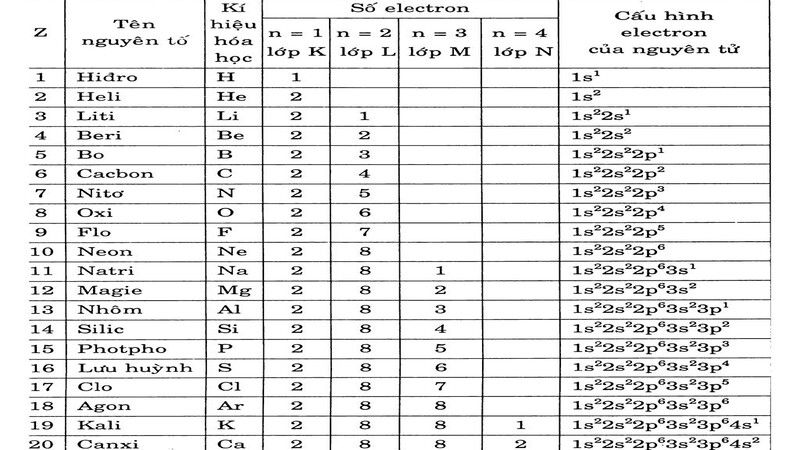
Bảng cấu hình electron nguyên tử của 20 nguyên tố thường gặp nhất
Bài tập về Electron có đáp án
Bài tập 1: Nguyên tử X có ký hiệu 2656X. Cho các phát biểu sau về X:
(1) Nguyên tử của nguyên tố X có 8 electron ở lớp ngoài cùng.
(2) Nguyên tử của nguyên tố X có 30 notron trong hạt nhân.
(3) X là một phi kim.
(4) X là nguyên tố d.
Trong các phát biểu trên, những phát biểu đúng là?
A. (1), (2), (3) và (4).
B. (1), (2) và (4).
C. (2) và (4).
D. (2), (3) và (4).
Hướng dẫn:
Do có sự chèn mức NL nên electron được phân bố như sau:
1s22s22p63s23p64s23d6
Cấu hình electron của X: 1s22s22p63s23p63d64s2hay [Ar] 3d64s2
– Số e lớp ngoài cùng là 2 do đó X là Kim loại
– N = A – Z = 56 – 26 = 30
– Electron cuối cùng phân bố trên phân lớp 3d nên X là nguyên tố d.
⇒ Chọn C.
Bài tập 2: Cấu hình electron nào sau đây viết sai?
A. 1s22s22p5
B. 1s22s22p63s23p64s1
C. 1s22s22p63s23p64s24p5
D. 1s22s22p63s23p63d34s2
Hướng dẫn:
Cấu hình 1s22s2p63s23p64s24p5 thiếu phân lớp 3d. Trước khi electron được điền vào phân lớp 4p phải điền vào phân lớp 3d.
⇒ Chọn C.
Bài tập 3: Một nguyên tố d có 4 lớp electron, phân lớp ngoài cùng đã bão hòa electron. Tổng số electron s và electron p của nguyên tố này là
Hướng dẫn:
Nguyên tố d có 4 lớp electron → electron cuối cùng trên phân lớp 3d.
Cấu hình electron của nguyên tố này có dạng: 1s22s22p63s23p63dX4s2.
Vậy tổng số electron s và electron p là 20
Bài tập 4: Nguyên tử nguyên tố Y có số khối là 16. Trong hạt nhân của Y, số hạt mang điện bằng số hạt không mang điện. Cấu hình electron của Y là
A 1s22s22p4.
B 1s22s22p63s23p4.
C 1s22s22p6.
D 1s22s22p63s23p6.
Đáp án: A
– Số khối: A = Z + N
– Hạt nhân chứa p (mang điện) và n (không mang điện)
– Nguyên tử nguyên tố Y có số khối là 16 → Z + N = 16 (1)
– Trong hạt nhân của Y, số hạt mang điện bằng số hạt không mang điện → Z = N (2)
Giải (1) và (2) ⟹ Z = N = 8
→ Cấu hình e của Y: 1s22s22p4
Bài tập 5: Một nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Xác định số hiệu nguyên tử của X. Viết cấu hình e của X
Hướng dẫn:
Z = 2 + 8 + 4 = 14
Cấu hình e của X là 1s22s2p63s23p2
Xem thêm:
- Este là gì? Tính chất vật lý, hóa học và công thức cấu tạo của hợp chất este
- C là gì trong hóa học? Khái niệm, công thức tính C và các bài tập ví dụ có đáp án
- Tính chất hóa học đặc trưng của kim loại là gì? Ví dụ tính chất hóa học kim loại
Bên trên là tổng hợp những kiến thức cơ bản của electron và cách viết cấu hình electron của một phân tử. Mong rằng bài viết này sẽ hỗ trợ quá trình học tập của các bạn học sinh. Và các bạn cũng đừng quên ôn và luyện tập các dạng bài về electron thật nhuần nhuyễn để nắm vững mảng kiến thức này nhé!











