Axetilen – khí đất đèn, còn được biết đến với công thức hóa học C2H2, là một chất có sự đa dạng ứng dụng trong nhiều lĩnh vực công nghiệp. Bài viết sau đây, Trong bài viết này, hãy cùng Bamboo School tìm hiểu rõ hơn khái niệm, tính chất và những ứng dụng quan trọng của axetilen để hiểu rõ hơn về axetilen và đóng góp của nó trong ngành công nghiệp.

Axetilen – C2H2 là gì? Công thức hóa học của Axetilen
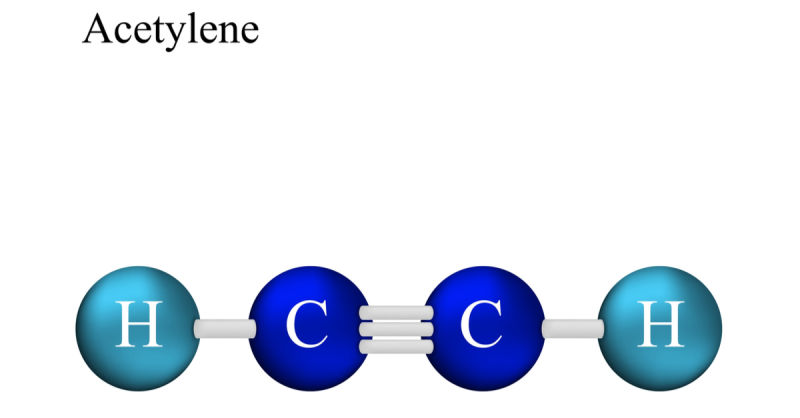
Axetilen còn được gọi là etin, là một hydrocacbon không no, có công thức phân tử C2H2. Đây là một khí không màu, có mùi đặc trưng, dễ cháy và tan trong các dung môi hữu cơ.
Đặc điểm
- Axetilen là một hydrocacbon không no, có công thức phân tử C2H2.
- Là khí không màu, có mùi đặc trưng, dễ cháy và tan trong các dung môi hữu cơ.
- Trong phân tử axetilen, có 2 nguyên tử C liên kết đôi với nhau bằng 1 liên kết π và liên kết đơn với 2 nguyên tử H.

Công thức cấu tạo:
- Công thức phân tử: C2H2
- Công thức cấu tạo: H-C≡C-H, viết gọn HC ≡ CH.
Tính chất vật lý C2H2 – Axetilen
Axetilen là một chất khí không màu, không mùi ở nồng độ thấp. Khi nồng độ cao, axetilen có mùi giống như tỏi hoặc hành tây. Dưới đây là một số tính chất vật lý của axetilen:
Trạng thái và màu sắc
- Ở điều kiện thường, axetilen là khí không màu.
- Nhiệt độ sôi: -84,7°C. Do đó, ở nhiệt độ phòng, axetilen là chất khí.
- Áp suất hơi ở 20°C: 44 atm.
Mùi
- Ở nồng độ thấp, axetilen không có mùi.
- Nhưng khi tăng nồng độ lên, C2H2 sẽ có mùi giống như tỏi hoặc hành tây.
- Mùi của axetilen giúp nhận biết sự rò rỉ khí axetilen.
Tính tan
- Axetilen hòa tan trong nước, cồn, ête và các dung môi hữu cơ khác.
- Độ hòa tan trong nước ở 20°C là 1,2 g/100 ml nước.
- Tính tan trong các dung môi hữu cơ giúp dễ dàng tinh chế và làm sạch.
Tính cháy
- Axetilen là chất rất dễ cháy, dễ nổ khi pha với không khí hoặc ôxy.
- Nhiệt độ tự cháy trong không khí là 305°C.
- Khi đốt, ngọn lửa axetilen rất nóng, có thể đạt tới nhiệt độ 3100°C.
- Do tính chất dễ cháy nổ, cần cẩn thận khi sử dụng và bảo quản.
Tính chất hóa học C2H2 – Axetilen
Axetilen là một hydrocacbon không no, nên rất dễ phản ứng với các chất khác. Dưới đây là một số phản ứng hóa học điển hình:
Phản ứng cháy (tác dụng với oxi)
Tương tự như các hidrocarbon khác như metan, etilen,… axetilen khi đốt cháy trong không khí sẽ tạo ra cacbonic và hơi nước.
2 C2H2 + 5 O2 (t°) → 4 CO2 + 2 H2O
Phản ứng cộng của Axetylen
Axetilen tham gia vào quá trình phản ứng cộng với halogen, hidro halogenua (như HCl, HBr,…), và AgNO3 trong môi trường amoniac.
Phản ứng cộng với halogen:
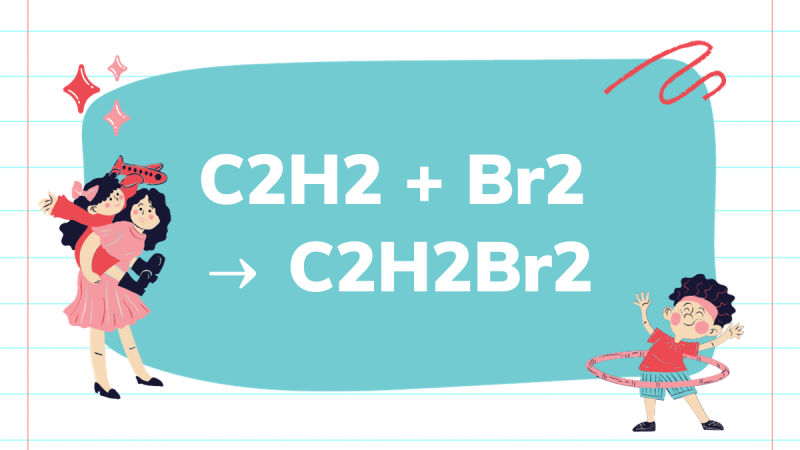
HC≡CH + Br–Br → Br–CH=CH–Br
Br–CH=CH–Br + Br–Br → Br2CH–CHBr2
Phản ứng cộng với hidro halogen:
HC≡CH + HBr → CH2=CHBr
Phản ứng cộng với bạc nitrat trong môi trường NH3
HC≡CH + AgNO3 + NH3 + H2O → Ag–C≡C–Ag ↓ màu vàng + NH4NO3
Phản ứng trùng hợp
Các phân tử C2H2 có thể kết hợp với nhau trong phản ứng trùng hợp và tạo thành polime.
nHC≡CH (t°, xt, p) → (–HC=CH–)n
Phản ứng hidrat hóa
Axetilen tham gia vào quá trình hidrat hóa với sự có mặt của xúc tác axit sulfuric, tạo thành sản phẩm cuối cùng là axit axetic, như được mô tả trong sơ đồ dưới đây:
HC≡CH + H2O(H2SO4) → H–CH=CH–H → CH3COOH
Phản ứng cộng
HC≡CH + Br2 → Br-CH=CH—Br (đibrometilen)
HC≡CH + 2 Br2 → Br2CH-CHBr2 (tetrabrometan)
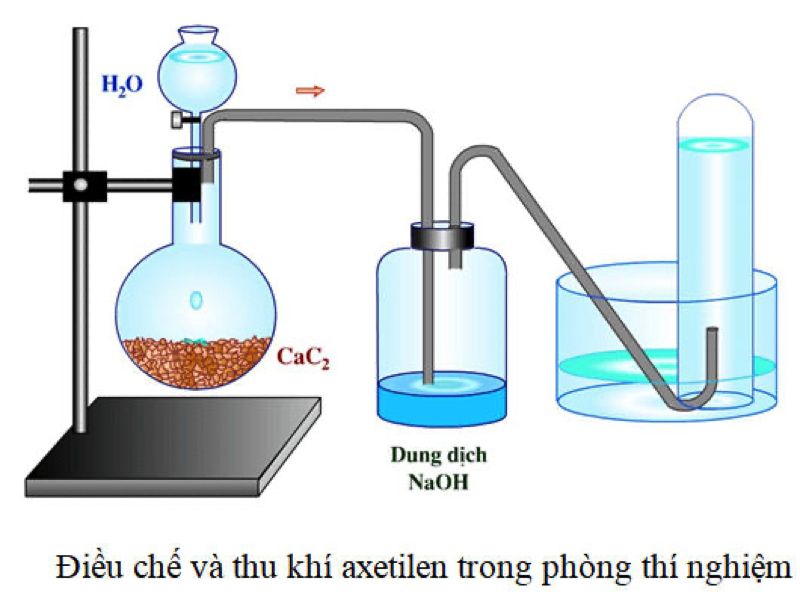
Cách điều chế axetilen
Có 3 phương pháp chính để điều chế C2H2:
Sử dụng Canxi Cacbua (CaC2):
Axetilen được sản xuất thông qua phản ứng của canxi cacbua với nước, theo phương trình:
CaC2 + 2H2O → C2H2 + Ca(OH)2
Cho Cacbon Tác Động với Hidro (Hồ Quang Điện):
Axetilen cũng có thể được tạo ra thông qua phản ứng của cacbon với hidro khi có ánh sáng điện, theo phương trình:
2C + H2 → C2H2 (hồ quang điện)
Nhiệt Phân Metan (CH4):
Nhiệt phân metan ở nhiệt độ cao, sau đó làm lạnh nhanh, tạo ra axetilen theo phương trình:
2CH4 → C2H2 + 3H2 (Điều kiện: 1500 °C)
Nhiệt Phân Metan (CH4):
Ứng dụng axetilen
Axetilen, với đa dạng tính chất và ứng dụng, đóng vai trò quan trọng trong nhiều lĩnh vực công nghiệp và sản xuất. Dưới đây là một số ứng dụng nổi bật:
Hàn Xì:
- C2H2 được sử dụng làm nhiên liệu trong quá trình hàn cắt kim loại, đặc biệt là trong đèn xì oxi-axetilen. Khi cháy trong không khí, nó tạo ra ngọn lửa có nhiệt độ cao lên đến 3000 độ, giúp hàn và cắt kim loại một cách hiệu quả.

Nguyên Liệu Sản Xuất Hóa Chất:
- Axetilen là nguyên liệu chính để sản xuất nhiều hợp chất hóa học quan trọng, bao gồm poli (vinyl clorua) được sử dụng trong sản xuất nhựa PVC, cao su, axit axetic và nhiều sản phẩm khác.
Sản Xuất Monome và Polime:
- Axetilen được sử dụng để sản xuất các monome, làm nguyên liệu cho quá trình tổng hợp polime. Các sản phẩm cuối cùng bao gồm sợi tổng hợp, cao su, muội than, và nhiều vật liệu tổng hợp khác.
Sản Xuất Axit Axetic và Rượu Etylic:
- Axetilen tham gia các quá trình hóa học để sản xuất axit axetic và rượu etylic, hai hợp chất có ứng dụng rộng rãi trong ngành công nghiệp hóa chất.

Chế Tạo Chất Hóa Học:
- Axetilen được sử dụng làm nguyên liệu chế tạo nhiều chất hóa học khác, đóng vai trò quan trọng trong quá trình sản xuất nhiều sản phẩm công nghiệp và hóa phẩm khác nhau.
Với những ứng dụng đa dạng này đã chứng minh vai trò quan trọng trong nền kinh tế và công nghiệp hiện đại.
Phân biệt axetilen, metan và etilen
Axetilen
- Công thức: C2H2
- Cấu trúc: liên kết π
- Tính chất: khí không màu, không mùi, dễ cháy
- Ứng dụng: hàn, cắt kim loại; tổng hợp hợp chất hữu cơ
Metan
- Công thức: CH4
- Cấu trúc: liên kết đơn
- Tính chất: khí không màu, không mùi, ít phản ứng hóa học
- Ứng dụng: nhiên liệu đốt, nguyên liệu hóa học
Etilen
- Công thức: C2H4
- Cấu trúc: liên kết đôi
- Tính chất: khí không màu, có mùi ngọt, dễ cháy
- Ứng dụng: tổng hợp nhựa polyetylen, cao su tổng hợp
Như vậy, các chất khí hydrocacbon C1, C2 có cấu trúc và tính chất khác nhau, dẫn tới ứng dụng cũng khác nhau.
Cách nhận biết hợp chất axetilen
Để nhận biết axetilen, có thể dựa vào các tính chất sau:
- Là khí không màu ở điều kiện thường.
- Có mùi đặc trưng giống tỏi, hành tây khi nồng độ cao.
- Tan trong nước, cồn, ête.
- Cháy trong không khí hoặc O2
Phương pháp nhận biết
Bước 1: Xác định tính chất riêng của từng chất cụ thể.
Bước 2: Lựa chọn thuốc thử.
Bước 3: Trình bày phương pháp nhận biết theo các bước sau:
- Đánh số thứ tự các lọ hóa chất.
- Tiến hành nhận biết.
- Ghi nhận hiện tượng.
- Viết phương trình hoá học
| Chất cần nhận | Loại thuốc thử | Hiện tượng | Phương trình hóa học |
| Metan (CH4) | Khí Clo | Mất màu vàng lục của khí Clo. | CH4 + Cl2 → CH3Cl + HCl |
| Etilen (C2H4) | Dung dịch Brom | Mất màu vàng nâu của Dung dịch Brom. | C2H4 + Br2 → C2H4Br2 |
| Axetilen (C2H2) | – Dung dịch Brom
– AgNO3/NH3 |
– Mất màu vàng nâu của Dung dịch Brom.
– Có kết tủa vàng |
– C2H2 + Br2 → C2H2Br4
– C2H2 + AgNO3 + NH3 → NH4NO3 + C2Ag2 |
Bài tập về axetilen SGK kèm gợi ý đáp án
Bài 1. Chất khí nào sau đây được dung làm nhiên liệu cho đèn xì để hàn cắt kim loại?
- cacbon monooxit.
- etilen.
- metan.
- axetilen.
Lời giải:
Đáp án D
Khi axetilen cháy trong oxi, nhiệt độ ngọn lửa có thể lên tới 3000oC. Vì vậy, axetilen được dùng làm nhiên liệu trong đèn xì oxi – axetilen để hàn, cắt kim loại.
Bài 2. Chọn nhận định đúng nhất trong số các nhận định sau:
Ở điều kiện thường:
- Metan, axetien đều làm mất màu dung dịch brom.
- Etilen, cacbonđioxit đều làm mất màu dung dịch brom.
- Metan, etilen, axetilen đều làm mất màu dung dịch brom.
- Etilen, axetilen đều làm mất màu dung dịch brom.
Lời giải:
Đáp án D
Loại A, B, C vì CH4; CO2 không làm mất màu dung dịch brom.
Bài 3: Biết rằng 4,48 lít khí etilen ở đktc làm mất màu 50 ml dung dịch brom aM. Nếu thay khí etilen bằng axetilen thì 4,48 lít axetilen đktc làm mất màu bao nhiêu ml dung dịch brom aM?
- 50 ml.
- 500 ml.
- 100 ml.
- 150 ml.
Lời giải:
Đáp án C
C2H4 + Br2 → C2H4Br2
0,2……0,2 mol
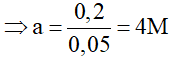
C2H2 + 2Br2 → C2H2Br4
0,2………0,4 mol
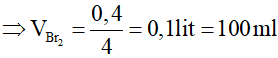
Bài 4: Cho 5,6 lít axetilen ở đktc phản ứng vừa đủ với V ml dung dịch Br2 0,8M. Giá trị của V là
- 62,5 ml.
- 625 ml.
- 312,5 ml.
- 31,25 ml.
Lời giải:
Đáp án B
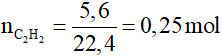
C2H2 + 2Br2 → C2H2Br4
0,25…..0,5 mol
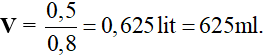
Bài 5. Đốt cháy hoàn toàn một hiđrocacbon X thì thu được 17,6 gam CO2 và 3,6 gam nước. Công thức phân tử của X là
- C2H2.
- C2H4.
- C2H6.
- C3H6.
Lời giải:
Đáp án A
Ta có:
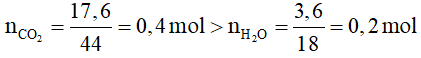
Trong 4 đáp án, chỉ có đốt cháy C2H2 cho
![]()
→ chọn A.
Bài 6. Một hiđrocacbon X thuộc cùng dãy đồng đẳng với C2H2. Biết X có tỉ khối hơi so với metan bằng 2,5. Công thức phân tử của X là
- C3H4.
- C4H6.
- C5H8.
- C3H6.
Lời giải:
Đáp án A
MX = 2,5.16 = 40.
Vậy X là C3H4 thỏa mãn.
Bài 7: Đốt cháy hoàn toàn 5,6 lít hỗn hợp khí A gồm metan và axetilen thu được 8,96 lít CO2 ở điều kiện tiêu chuẩn. Phần trăm theo thể tích của mỗi khí trong hỗn hợp A lần lượt là
- 30% và 70%.
- 50% và 50%.
- 40% và 60%.
- 45% và 55%.
Lời giải:
Đáp án C
Đặt số mol CH4 và C2H2 lần lượt là x và y (mol)
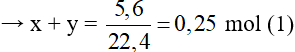
Phương trình hóa học:
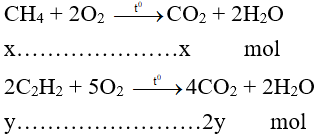
→ x + 2y = 0,4 (2)
Từ (1) và (2) có x = 0,1 và y = 0,15.
Ở cùng điều kiện tỉ lệ về thể tích cũng là tỉ lệ về số mol.
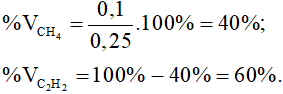
Bài 8. Cho 0,78 gam axetilen vào 100 ml dung dịch brom có nồng độ 0,7M. Hỏi hiện tượng gì sẽ xảy ra?
- Màu nâu đỏ của nước brom mất màu hoàn toàn.
- Màu nâu đỏ của nước brom bị nhạt đi.
- Không có hiện tượng gì.
- Dung dịch brom bị mất màu, sau đó lại đậm dần lên.
Lời giải:
Đáp án B
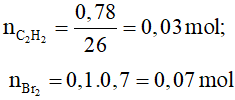
C2H2 + 2Br2 → C2H2Br4
0,03 ……0,06 mol
Vậy sau phản ứng vẫn còn Br2 dư, do đó hiện tượng quan sát được:
Màu nâu đỏ của nước brom bị nhạt đi.
Bài 9. Cho hỗn hợp Y gồm C2H4 (0,1 mol); C2H2 (0,2 mol); và H2 (0,5 mol). Nung nóng hỗn hợp Y với bột Ni cho đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp Z. Đốt cháy hoàn toàn hỗn hợp Z cần dùng thể tích oxi (ở đktc) là
- 23,52 lít.
- 11,2 lít.
- 24,2 lít.
- 56 lít.
Lời giải:
Đáp án A
Đốt cháy Z tương đương như đốt cháy Y
Phương trình hóa học:
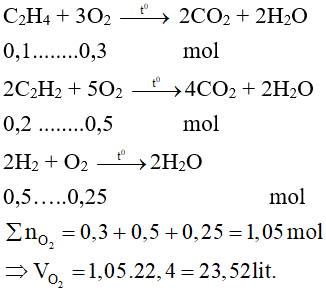
Bài 10: Dẫn 8,96 lít hỗn hợp khí gồm CH4; C2H4; C2H2 vào lượng dư dung dịch brom thấy có 2,24 lít khí thoát ra và có 80,0 gam brom đã tham gia phản ứng. Phần trăm thể tích của CH4; C2H4; C2H2 trong hỗn hợp ban đầu lần lượt là (biết thể tích các khí đều đo ở cùng đktc)
- 20%; 20% và 60%.
- 25%; 25% và 50%.
- 30%; 30% và 40%.
- 50%; 25% và 25%.
Lời giải:
Đáp án B
Gọi số mol của CH4; C2H4 và C2H2 lần lượt là x, y và z (mol)
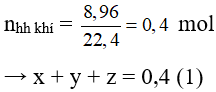
Cho hỗn hợp khí vào dung dịch brom dư:
C2H4 + Br2 → C2H4Br2
y y mol
C2H2 + 2Br2 → C2H2Br4
Z 2z mol
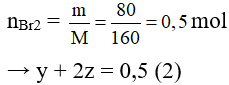
Khí thoát ra là CH4
Thay x = 0,1 vào (1) có y + z = 0,3 (3)
Từ (2) và (3) giải hệ phương trình được y = 0,1 và z = 0,2.
Ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cùng là tỉ lệ về số mol
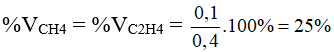
%VC2H2 = 100% – (25% + 25%) = 50%.
Kết luận
C2H2 là một hydrocacbon không no, có cấu trúc phân tử với một liên kết π. Đây là chất khí không màu, có mùi đặc trưng và rất dễ cháy. Nó tham gia nhiều phản ứng hóa học quan trọng, được ứng dụng rộng rãi trong công nghiệp và đời sống. Tuy nhiên, cần cẩn thận khi sử dụng và bảo quản axetilen vì tính chất dễ cháy, dễ nổ của nó.










